Corps étranger oculaire
Dr Thomas DULAURENT, Dr Pierre-François ISARD, Laure STEUN – ASV (Centre de spécialistes en ophtalmologie vétérinaire)
Un Bichon mâle castré de 8 ans a été présenté en consultation d’ophtalmologie en urgence pour l’évaluation d’un corps étranger localisé en chambre antérieure de l’œil droit suite à une promenade l’après-midi même. Le chien n’était pas tenu en laisse et se déplaçait alors librement.
Examen général
L’examen général n’a pas révélé d’anomalie.
EXAMEN OCULAIRE
Les réponses aux tests visuels étaient positives à gauche. La réponse à la menace était positive à droite tandis que la réponse à l’éblouissement était variable et difficilement interprétable en raison de la douleur oculaire, matérialisée par un blépharospasme d’intensité modérée. L’examen oculaire gauche n’a pas révélé d’anomalie. L’examen oculaire droit a révélé la présence d’un épiphora peu abondant. Un corps étranger curvilinéaire, de couleur blanche était présent en chambre antérieure. L’examen rapproché au biomicroscope a révélé qu’il s’agissait d’une griffe de chat, dont le point de pénétration cornéen était localisé au quadrant supéronasal. Ce dernier était comblé par un caillot de fibrine. Un œdème cornéen discret était présent, ainsi qu’une réaction uvéale manifestée par un myosis serré pénalisant l’observation du cristallin (Photographie 1). La pression intraoculaire était de 7 mm Hg, mesurée par tonométrie à rebond.
Devant la nature des signes, une chirurgie d’extraction du corps étranger a été proposée, associée à l’exploration périopératoire du cristallin.
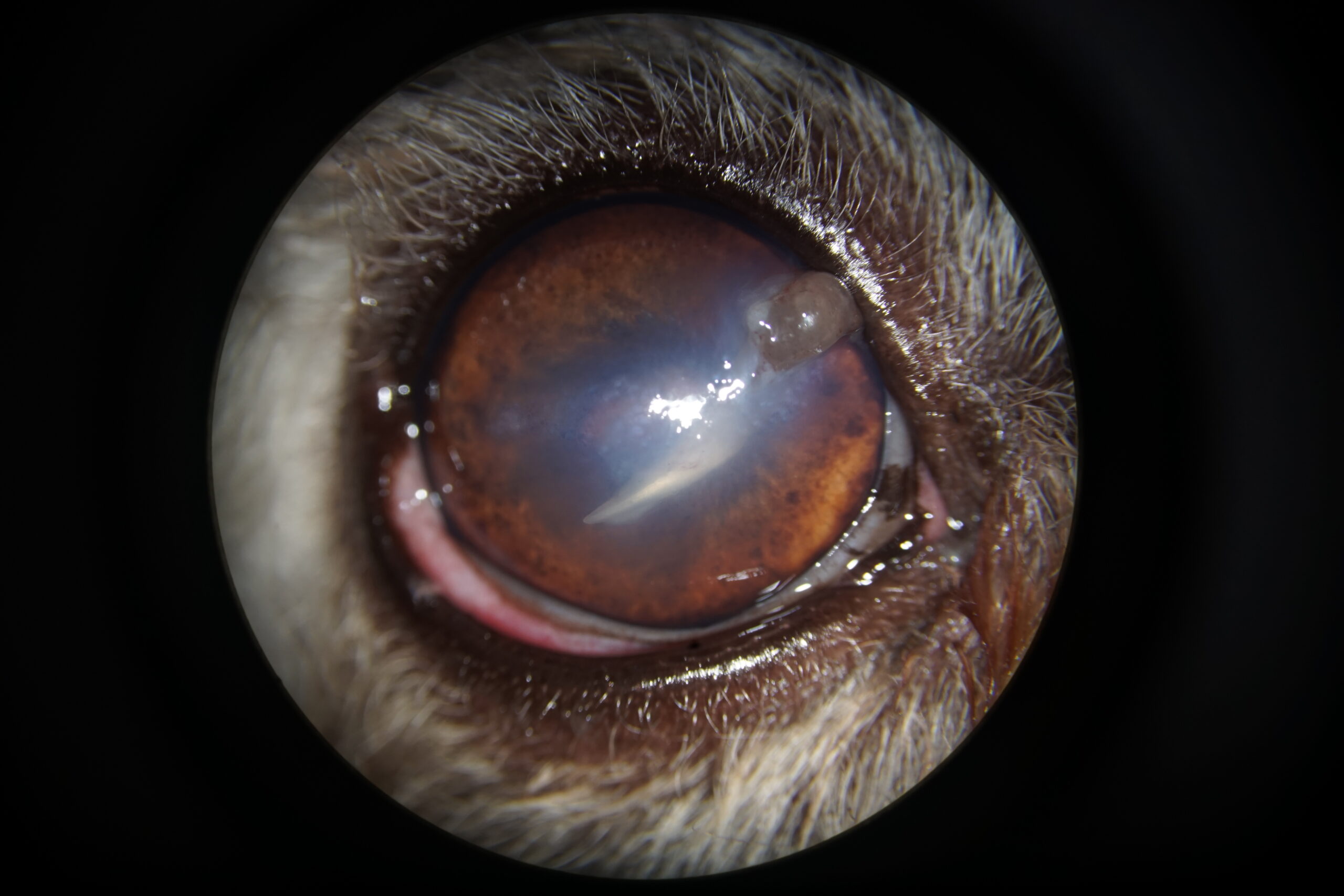 Photographie 1: Aspect de l’oeil à l’admission. Noter la griffe cassée en chambre antérieure, l’œdème cornéen,
Photographie 1: Aspect de l’oeil à l’admission. Noter la griffe cassée en chambre antérieure, l’œdème cornéen,
la fibrine colmatant le point d’entrée et la réaction uvéale matérialisée par un myosis.
PROCÉDURE CHIRURGICALE
L’induction de l’anesthésie a été obtenue par injection intraveineuse de propofol après tranquillisation par administration intraveineuse de valium. L’anesthésie a ensuite été maintenue par administration d’un mélange d’oxygène et d’isoflurane par voie respiratoire après intubation endotrachéale. L’analgésie a été obtenue par injection intraveineuse de morphine, complétée par l’instillation locale de chlorhydrate d’oxyburpocaïne. Après positionnement du patient en décubitus dorsal, la tête maintenue dans un coussin à dépression, le site chirurgical a été préparé pour l’intervention par six nettoyages consécutifs à l’aide d’une solution de povidone iodée diluée à 1%.
La chambre antérieure a été stabilisée par injection intracamérale d’un gel viscoélastique (acide hyaluronique 1.6%, Ophteis Bio) par un port de kératotomie perforante à 12h. La base de la griffe étant crénelée, il a été impossible de la faire sortir par le point de pénétration, c’est pourquoi un autre port de kératotomie perforante a été réalisé à 10h. La griffe a été saisie à l’aide d’une pince de Bohn, puis retirée délicatement. Le point d’entrée de la griffe et le port de 10h ont été suturés par points simples à l’aide de polyglactine 9/0 (Vicryl 9/0). La pupille a ensuite été dilatée par injection d’adrénaline en chambre antérieure. La cristalloïde antérieure était rompue et une cataracte traumatique hétérogène était déjà développée (Photographie 2).
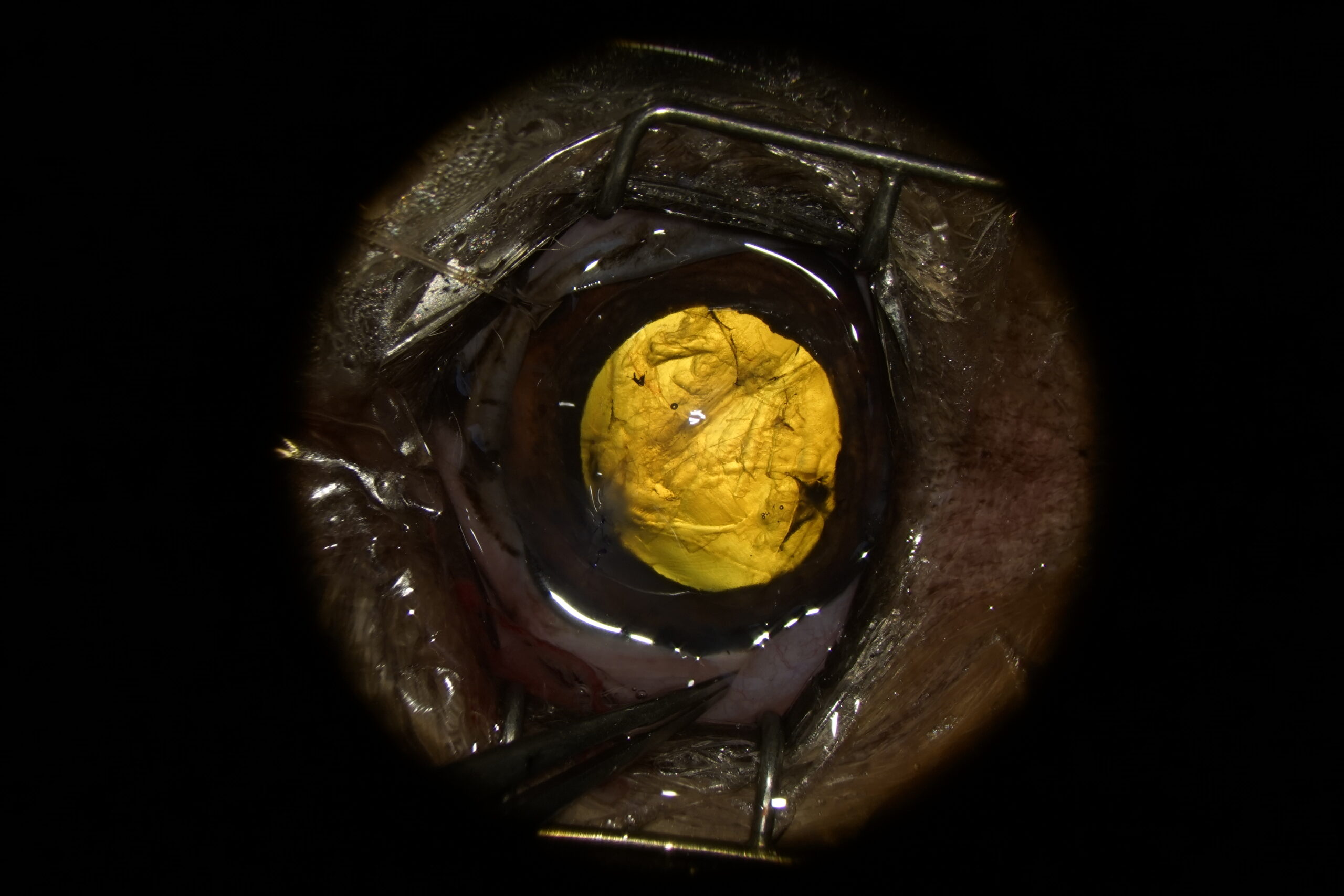 Photographie 2 : Aspect de l’œil après exérèse de la griffe, reconstruction de la cornée et mydriase pharmacologique.
Photographie 2 : Aspect de l’œil après exérèse de la griffe, reconstruction de la cornée et mydriase pharmacologique.
La déchirure de la capsule antérieure est vaste et complexe. L’architecture du cristallin est bouleversée.
Le cristallin a donc été éliminé par phakoémulsification par le port de 12h. Après ablation des masses par irrigation / aspiration, la déchirure de la capsule antérieure a été sculptée avant l’injection d’un implant (PFI 4X, Medicontur). Le port de kératotomie de 12h a été suturé par trois points simples au Vicryl 9/0 après élimination du matériel viscoélastique résiduel par irrigation aspiration. A ce stade de la chirurgie, une déchirure de l’endothéliodescemet était visible, suivant la trajectoire la plus probable de la griffe en chambre antérieure (Photographie 3).
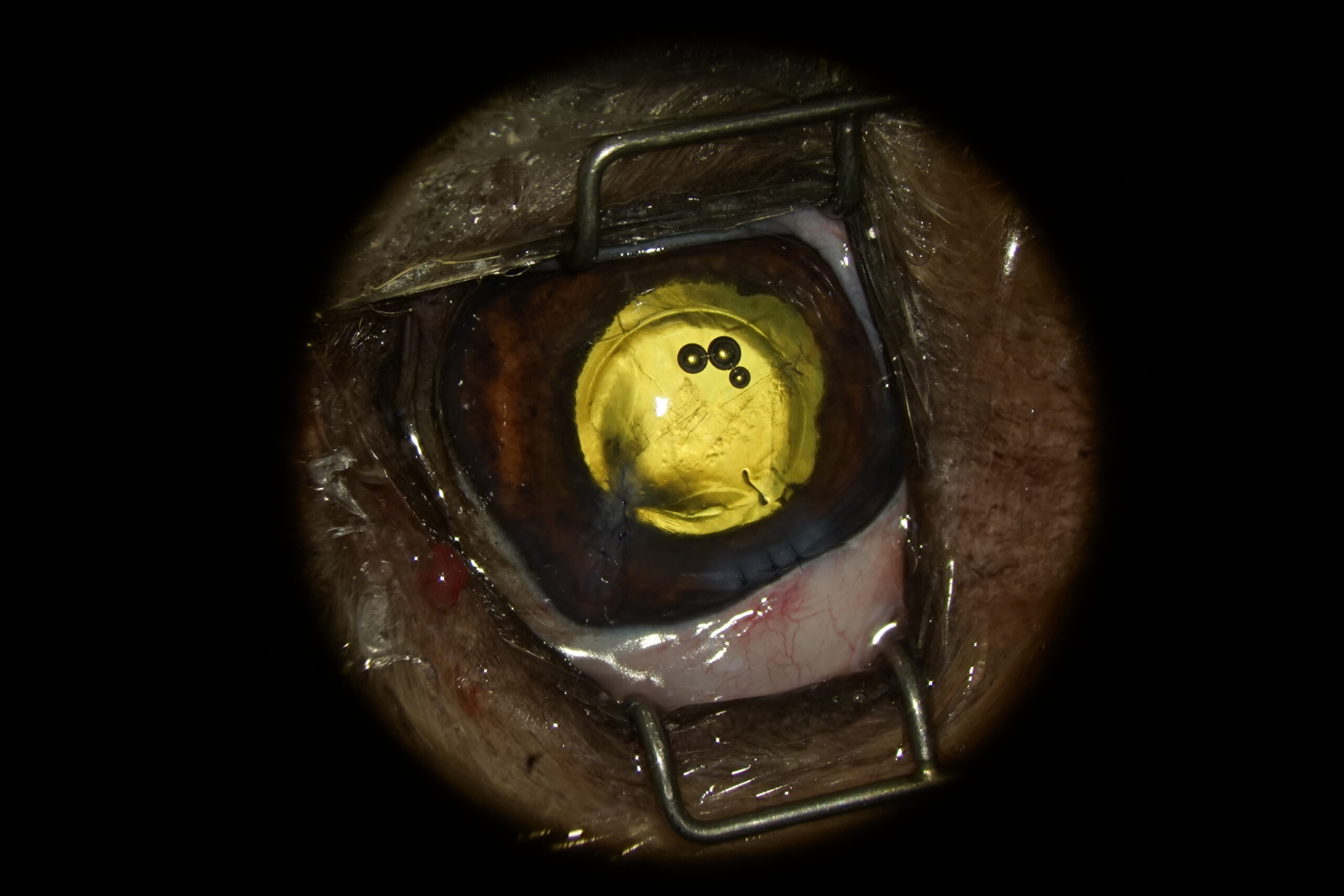
Photographie 3 : Aspect de l’œil après implantation. L’endothéliodescemet est déchiré,
ce qui provoque la formation précoce de loges hydriques dans le stroma cornéen
Des bulles hydriques étaient déjà en formation dans le stroma cornéen. Une injection de 0,25µg de tpa a été réalisée en chambre antérieure en fin d’intervention afin de limiter les collections fibrineuses post opératoires. La griffe a été envoyée au laboratoire pour analyse bactériologique.
TRAITEMENT MÉDICAL POST-OPÉRATOIRE
Le traitement médical prescrit a consisté en l’administration d’antibiotiques par voie locale (Tobramycine collyre, Tobrex®, ALCON, TiD) et générale (Amoxicilline et clavulanate, Bioclamox®, Axience, 12,5 mg/kg PO BiD, 10 jours) et d’antiinflammatoires stéroïdiens par voie générale (Prednisolone, Megasolone®, DOPHARMA, 0,5 mg/kg PO SiD, 1 semaine), associée à l’administration locale d’un cycloplégique (Atropine Collyre 1%, ALCON, TiD 1 semaine).
SUIVI
L’analyse bactériologique a révélé une contamination de la griffe par Pasteurella spp, sensible à la tobramycine. La visite de contrôle à une semaine a montré une importante dégradation de l’œdème cornéen, qui occupait alors l’ensemble de la surface cornéenne. Le reflet pupillaire n’était pas visible et les plaies de kératotomie ainsi que le point d’entrée de la griffe apparaissaient exagérément œdématiés (Photographie 4).
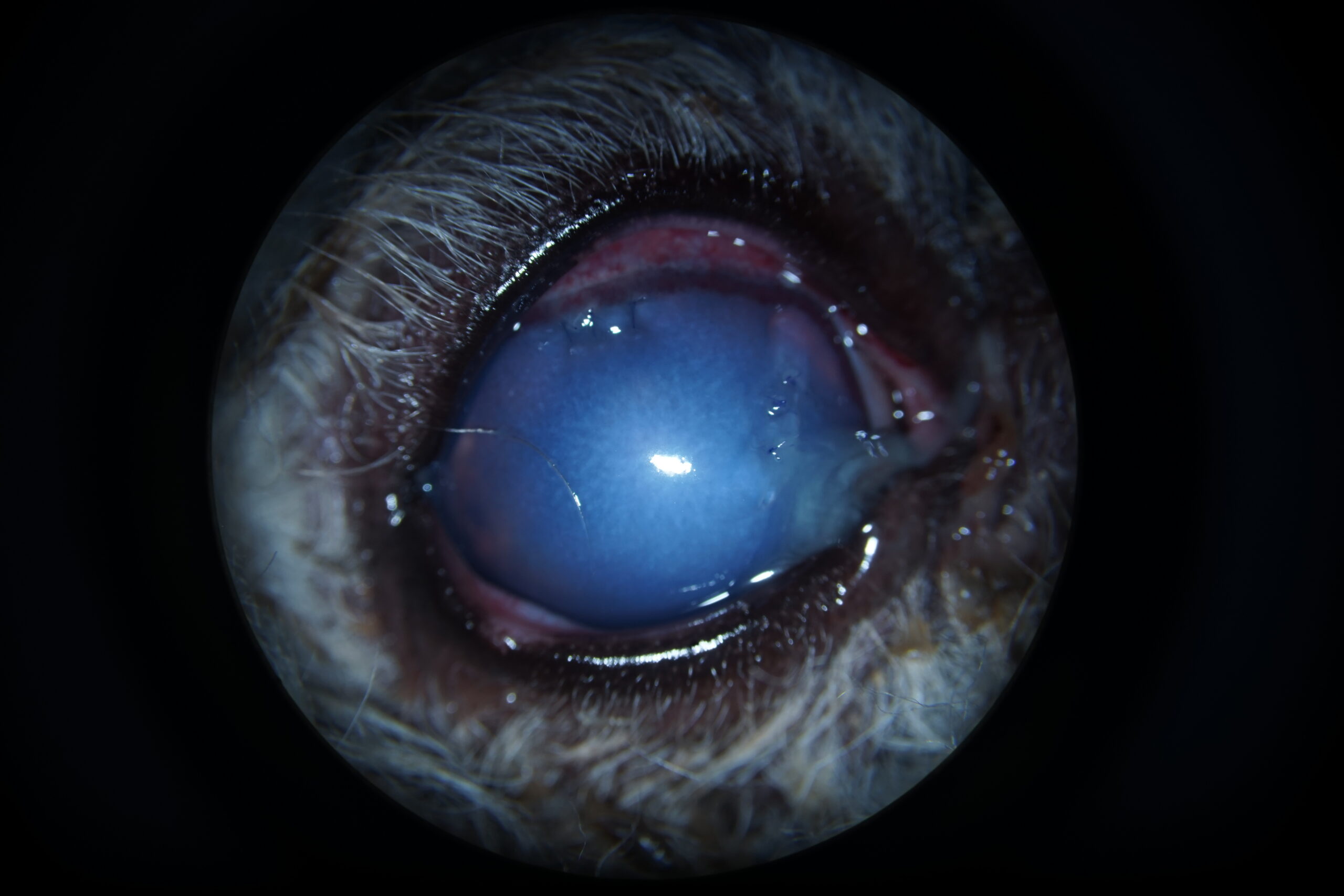 Photographie 4 : Aspect de l’œil une semaine après l’intervention. Noter l’œdème cornée masquant
Photographie 4 : Aspect de l’œil une semaine après l’intervention. Noter l’œdème cornée masquant
la chambre antérieure, l’injection ciliaire et la tuméfaction du port de kératotomie à 12h
Le confort du patient était légèrement amélioré, avec persistance d’un discret blépharospasme majoré par l’examen. La pression intraoculaire a été mesurée à 10 mm Hg par tonométrie à rebond. Il a été décidé de poursuivre le traitement médical sans modification.
La visite de contrôle à 3 semaines a montré une nette amélioration de la transparence cornéenne, avec persistance de l’œdème au niveau des ports, du point de pénétration de la griffe et de la zone de déchirure de l’endothéliodescemet. Le confort du patient était satisfaisant avec disparition presque totale du blépharospasme (Photographie 5).
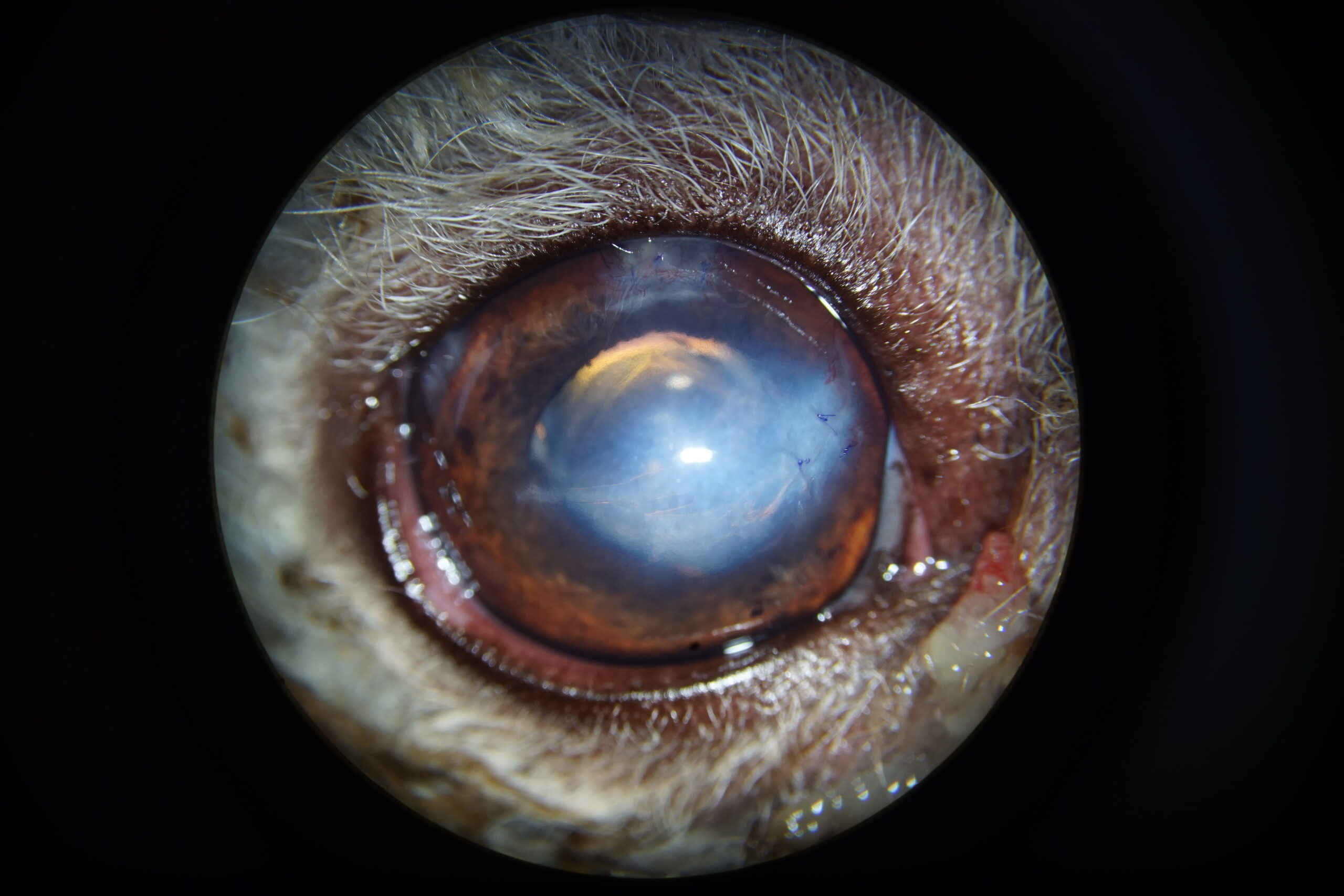 Photographie 5 : Aspect de l’œil trois semaines après l’intervention. L’intensité de l’œdème cornéen décroit.
Photographie 5 : Aspect de l’œil trois semaines après l’intervention. L’intensité de l’œdème cornéen décroit.
La déchirure de l’endothéliodescemet est toujours visible.
La pression intraoculaire a été mesurée à 8 mm Hg par tonométrie à rebond. Le traitement médical a consisté en l’instillation locale de dexaméthasone (Maxidex®, ALCON, TiD) pendant 3 mois.
Les différentes visites de contrôle ont montré une amélioration du confort avec disparition du blépharospasme. L’œdème cornéen était largement amélioré. Les tests visuels étaient positifs et la PIO stable. Six mois après la chirurgie, les séquelles observables étaient la persistance d’un discret œdème cornéen dans la zone du point de pénétration de la griffe et une dyscorie (Photographie 6).
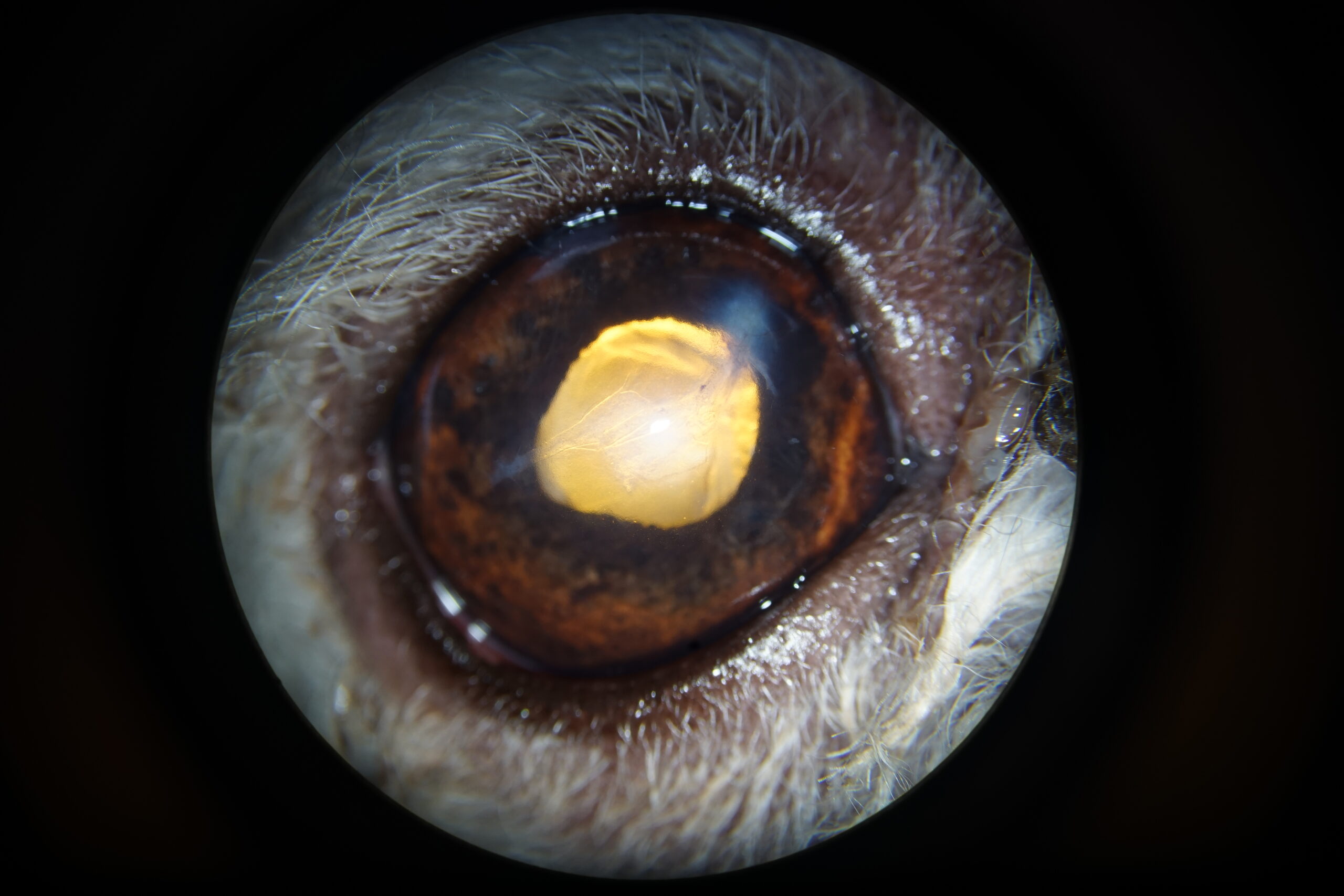 Photographie 6 : Aspect de l’œil 6 mois après l’intervention.
Photographie 6 : Aspect de l’œil 6 mois après l’intervention.
L’œdème est réduit. La cornée est fibrosée au point d’impact.
La zone de déchirure de l’endothéliodescemet était toujours visible à fort grossissement (Photographie 7).
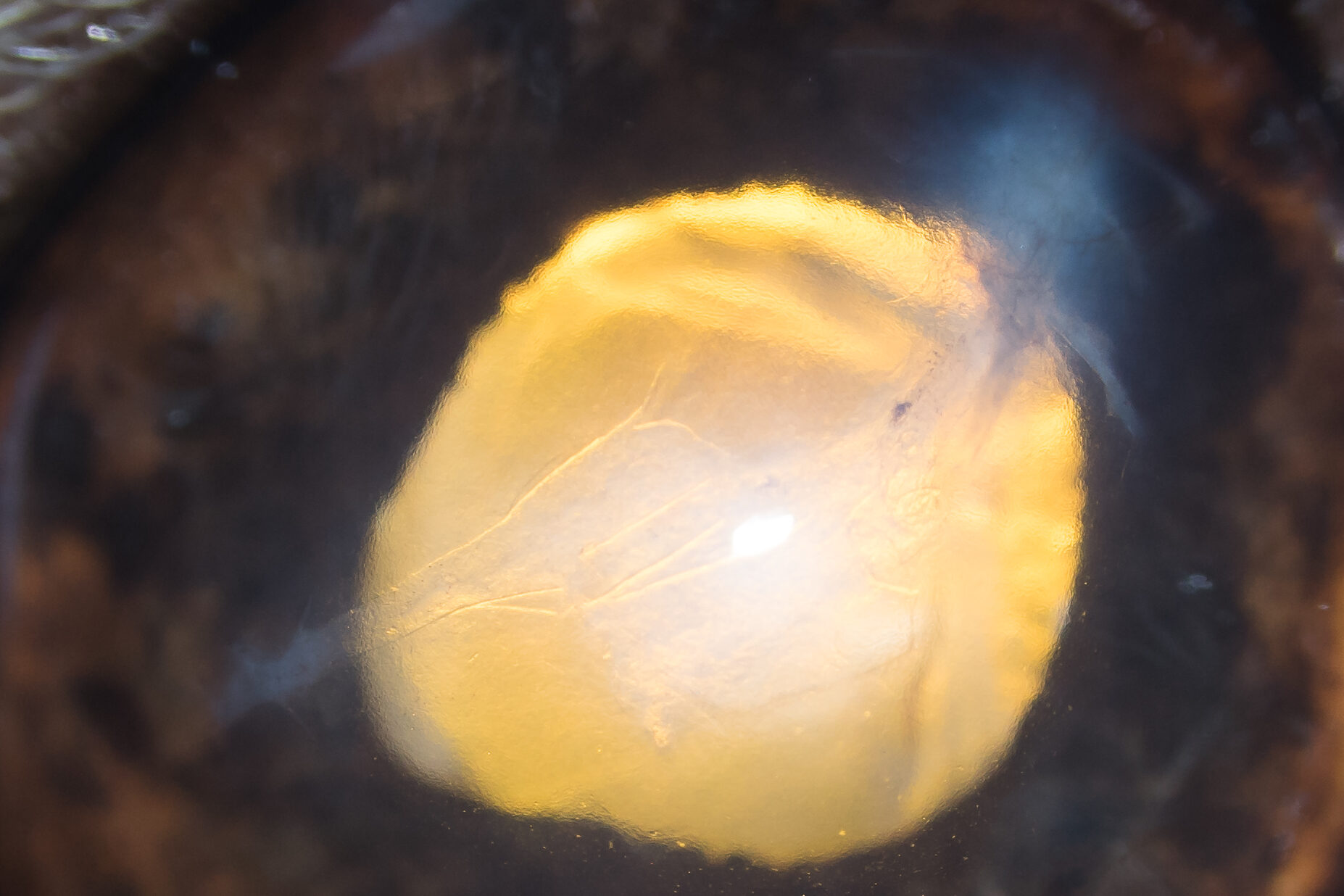 Photographie 7 : Fort grossissement de la photographie 6 montrant la déchirure
Photographie 7 : Fort grossissement de la photographie 6 montrant la déchirure
de l’endothéliodescemet et l’œdème cornéen associé
Un an après la chirurgie, les tests visuels était positifs. La cornée présentait de la fibrose au point d’impact et en regard de la déchirure de l’endothéliodescemet, par ailleurs toujours visible (Photographie 8).
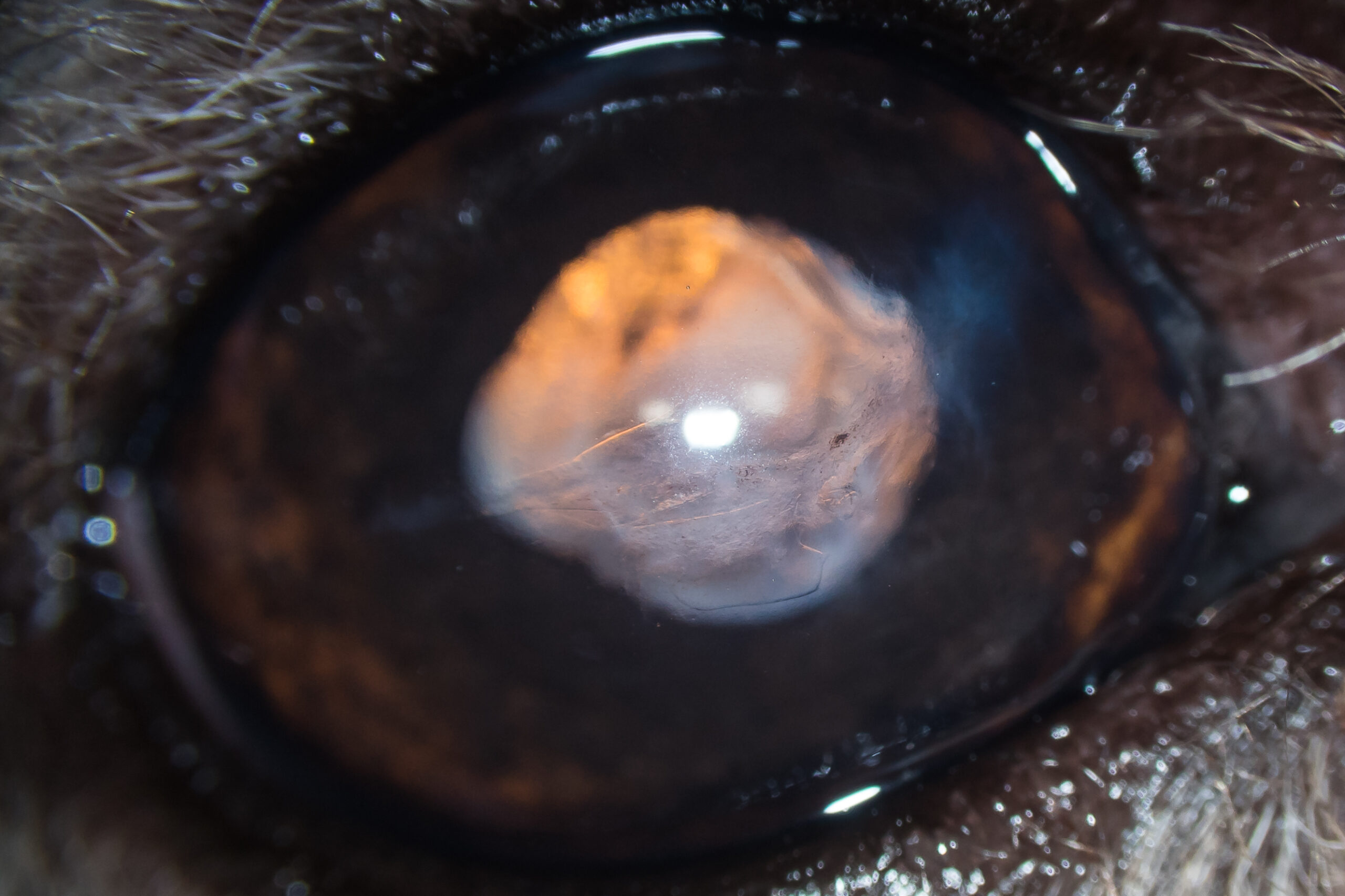 Photographie 8 : Aspect de l’œil 1 an après la chirurgie. La cornée présente un léger degré de fibrose
Photographie 8 : Aspect de l’œil 1 an après la chirurgie. La cornée présente un léger degré de fibrose
au point d’entrée de la griffe et au niveau de la rupture de l’endothéliodescemet.
La pupille était légèrement déformée et la capsule du cristallin partiellement fibrosée. L’OCT de la cornée a révélé une métaplasie fibreuse de l’endothélium et une probable duplication de la membrane de Descemet. La pression intraoculaire a été mesurée à 13 mm Hg par tonométrie à rebond.
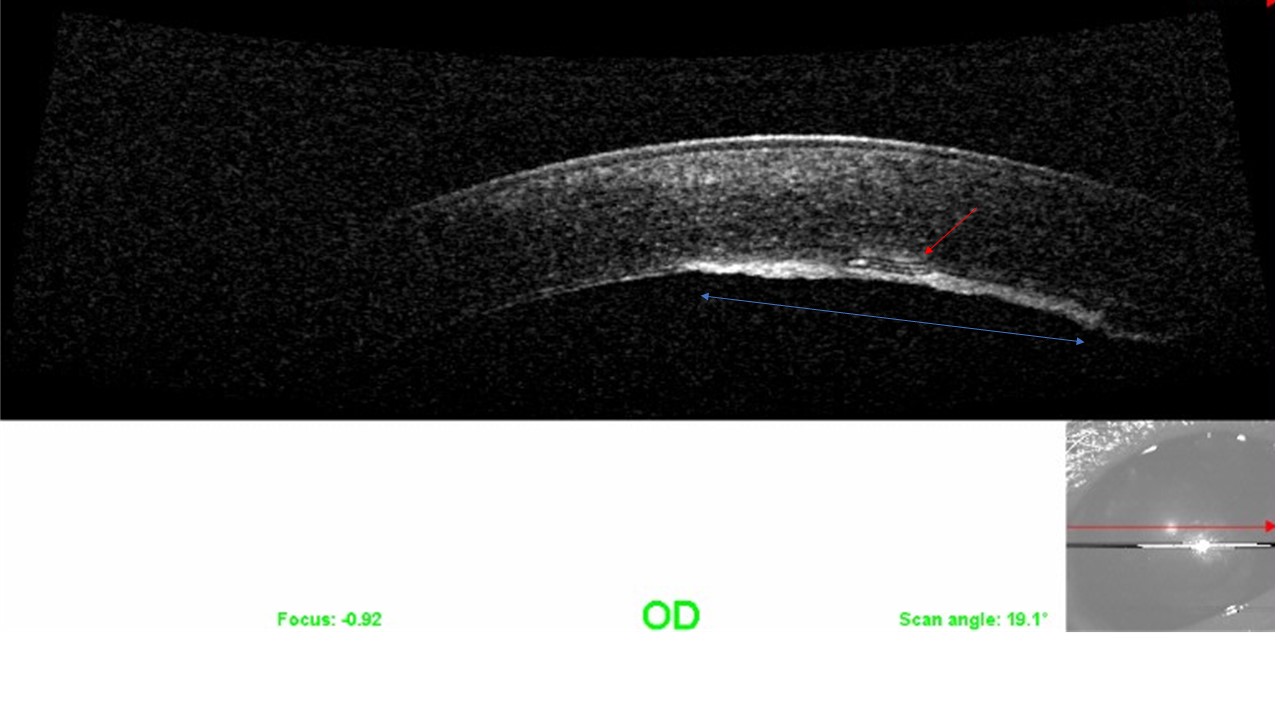 Photographie 9 : OCT de la cornée 1 an après la chirurgie. Noter la métaplasie fibreuse de l’endothélium (flèche bleue)
Photographie 9 : OCT de la cornée 1 an après la chirurgie. Noter la métaplasie fibreuse de l’endothélium (flèche bleue)
et une probable duplication de la membrane de Descemet (Flèche rouge).
DISCUSSION
Les traumatismes de la surface oculaire par griffure de chat sont un motif de consultation fréquent en ophtalmologie vétérinaire1-4. Chez le chien, cette situation survient le plus souvent chez des sujets adolescents, suite à l’introduction dans le nouveau foyer où vit déjà un chat1. Le jeune chien, par son attitude naïve et son comportement explorateur, va à la rencontre du chat du foyer, animal territorial et potentiellement agressif par nature. Ici, le patient était adulte mais présentait un caractère belliqueux vis-à-vis des chats depuis toujours, majorant le risque de blessure.
Les effets délétères des griffures de chats sont liés au traumatisme1-8, au risque sceptique9-12 et à la réaction immunitaire mise en jeu13-16. Les griffes des chats sont en effet naturellement tranchantes, en lien avec la prédation. Les lésions sont souvent graves et correspondent à un traumatisme coupant. Elles s’étendent d’une simple déchirure de la conjonctive à des lacérations cornéennes parfois associées à des déchirures de la capsule antérieure du cristallin avec libération de matériel cristallinien en chambre antérieure1, 2. Dans notre cas, la griffure avait provoqué à la fois une plaie de cornée et du cristallin. Par ailleurs, les griffes sont porteuses de nombreuses bactéries qu’elles sont susceptibles d’inoculer dans l’œil au moment du traumatisme (Escherichia coli, Pseudomonas aeruginosa, β-hemolytic streptococci, Pasteurella multocida, Bartonella henselae, Moraxella spp, Staphylococcus spp, Streptococcus spp…), pouvant provoquer une endophtalmie bactérienne9-11. Dans notre cas, la griffe était porteuse de Pasteurella spp., germe ubiquitaire, mais aucun signe d’infection n’était encore visible, le patient ayant été présenté quelques heures seulement après le traumatisme. Enfin lorsque le cristallin est impliqué, le système immunitaire peut être mis au contact de protéines cristalliniennes initialement séquestrées1, 13-16. L’uvéite phacoclastique qui en résulte est souvent sévère et associée à une inflammation impliquant des neutrophiles intralenticulaires et une fibroplasie périlenticulaire1, 13.
Les corps étrangers oculaires sont assez fréquents en ophtalmologie vétérinaire17-25. Les corps étrangers organiques (épines végétales, aiguilles, écorces, épines de porc-épic) sont plus souvent associés à des endophtalmies bactériennes que les corps étrangers non organiques (verre, plastique, métal…)26. Le diagnostic de corps étranger intraoculaire est souvent plus difficile à établir que les corps étrangers de surface, en raison de leur localisation parfois marginale (angle irido-cornéen) et de la réaction inflammatoire souvent intense les masquant (exsudat fibrino-hémorragique)17. Dans notre cas, le diagnostic de corps étranger était facile en raison de son importante taille et d’un œdème cornéen et d’une réaction uvéale étonnamment faibles. Lorsque les corps étrangers sont localisés seulement à la surface de la cornée, une ablation par hydropulsion peut suffire27. Lorsque les corps étrangers sont pénétrants, la prise en charge nécessite souvent une intervention chirurgicale consistant en l’exérèse du corps étranger, en la reconstruction de la cornée et en l’ablation mécanisé du cristallin lorsque ce dernier est impliqué17-18.
Dans notre cas la griffe a pénétré en chambre antérieure par un point d’entrée cornéen assez petit. Le scénario le plus probable est que la griffe se soit rompue au début de la griffade et non pas à la fin, minimisant la lacération cornéenne. Toutefois, en pénétrant en chambre antérieure, la griffe a lacéré à la fois l’endothélio-Descemet et la capsule antérieure du cristallin, désorganisant aussi le cortex antérieur. La prise en charge chirurgicale a logiquement consisté en l’exérèse du corps étranger, en la reconstruction de la cornée et en l’ablation du cristallin par phacoémulsification. Les recommandations dans la prise en charge des déchirures de la capsule antérieure sont contradictoires. Davidson et al. recommandent une prise en charge chirurgicale pour les déchirures supérieures à 1.5 mm à fortiori lorsque du matériel cristallinien a été expulsé en chambre antérieure après le traumatisme2. L’argument principal d’une attitude interventionniste est le risque de développement d’une uvéite phacoclastique ou d’un syndrome d’implantation septique2, 28. Ce syndrome se traduit par une endophtalmie grave et incoercible, d’évolution lente, survenant quelques semaines ou mois après un traumatisme oculaire et une rupture de la capsule antérieure, avec inoculation de microorganismes (bactéries, champignons)28. L’étude réalisée par Paulsen et al. en 2012 portant sur la prise en charge de 77 cas de lacération cornéenne associée à une déchirure de la capsule antérieure, a montré qu’une prise en charge médicale seule était de meilleur pronostic à long terme qu’une prise en charge chirurgicale de la cornée et du cristallin, à condition que la plaie de cornée offre une bonne apposition, que la chambre antérieure soit reconstituée par l’humeur aqueuse seconde sans iridocoele et que le test de Seidel soit négatif.1 Les auteurs évoquent la capacité de cicatrisation de la capsule antérieure par effusion de fibrine et métaplasie fibreuse de la capsule, permettant même après quelques mois de séquestrer à nouveau le matériel cristallinien initialement libéré en chambre antérieure1. Cette conclusion, plutôt contre-intuitive, n’a pas eu d’influence sur la prise en charge de notre cas, dans la mesure où la griffe était cassée en chambre antérieure après le traumatisme, nécessitant de toute façon une approche chirurgicale. La décision de pratiquer une phacoémulsification a été dictée par la déchirure vaste et complexe de la capsule antérieure et la désorganisation du cortex antérieur, même si le matériel cristallinien semblait encore en place.
La déchirure de l’endothélio-Descemet a quant à elle provoqué un important œdème cornéen par imbibition du stroma par l’humeur aqueuse, visible à la visite de suivi à une semaine. Les différentes visites de contrôle ont montré une évolution favorable de l’œdème avec une disparition presque totale 9 mois après la chirurgie. La phase endothéliale de la cicatrisation cornéenne débute normalement 24h après le traumatisme29. Chez le chien adulte, les cellules endothéliales sont incapables de mitose30. L’endothélium cicatrise principalement par des remaniements du cytosquelette des cellules qui le composent. Ces dernières occupent alors une surface plus importante et migrent par glissement afin combler le déficit lié au traumatisme. La densité en cellule endothéliale décroit après le traumatisme. Les cellules endothéliales subissent une métaplasie fibreuse et produisent une nouvelle membrane de Descemet après quelques semaines29. Une duplication de la membrane de Descemet peut survenir après des traumatismes perforant de la cornée31. Dans notre cas, la compensation endothéliale a permis le maintien de la déturgescence cornéenne pendant la période du suivi, assurant ainsi le maintien d’une vision satisfaisante pour le patient. La déchirure de l’endothéliodescemet restait néanmoins encore visible en lampe à fente à la visite de contrôle à un an.
Le cas présenté ici décrit la prise en charge d’une griffe de chat cassée dans la chambre antérieure d’un chien après lacération de la cornée. Les lésions cornéennes et cristalliniennes ont été traitées chirurgicalement et médicament avec succès. Le pronostic était amélioré par la prise en charge précoce du patient.
RÉFÉRENCES BIBLIOGRAPHIQUES
- Paulsen M.E., Kass P.H.. Traumatic corneal laceration with associated lens capsule disruption: a retrospective study of 77 clinical cases from 1999 to 2009. Veterinary Ophthalmology, 2012; 15: 355-368.
- Davidson M.G., Nasisse M.P., Jamieson V.E. et al. Traumatic anterior lens capsule disruption. Journal of the American Animal Hospital Association, 1991; 27: 410–414.
- Spiess B.M., Fuhli M.R., Bollinger J.. Eye injuries from cats claw at dog (in German). Schweizer Archiv fur Tierheilkunde, 1996; 138: 429–433.
- Denis H.M.. Anterior lens capsule disruption and suspected malignant glaucoma in a dog. Veterinary Ophthalmology, 2002; 5: 79–83.
- Doi M., Ikeda T., Yasuhara T., Koizumi K., Nakamura T.. A case of bacterial endophthalmitis following perforating injury caused by a cat claw. Ophthalmic Surgery and Lasers, 1999; 30: 315-316.
- Williams C.P., Sleep T.J., Morris R.J.. Lateral rectus muscle avulsion by a cat scratch. Journal of American Association for Pediatric Ophthalmology and Strabismus, 2002; 6: 397-399.
- Sylvester D.A., Burnstine R.A., Bower J.R.. Cat-inflicted corneal laceration: a presentation of two cases and a discussion of infection-related management. Journal of Pediatric Ophthalmology and Strabismus, 2002; 39:114-117.
- Borkar D., Avendano P.. Cat-inflicted eye injury in a child. Journal of Medical Cases, 2021; 12: 209-212.
- Oehler R.L., Velez A.P., Mizrachi M., Lamarche J., Gompf S.. Bite-related and septic syndromes caused by cats and dogs. Lancet Infectious Diseases, 2009; 9: 439–447.
- Weinberg A.N., Branda J.A.. Case records of the Massachusetts General Hospital. Case 31-2010. A 29-year-old woman with fever after a cat bite. The New England Journal of Medicine, 2010; 363: 1560–1568.
- Veraldi S., Minuti A.. Severe Streptococcal Infection Following Cat Scratch. Wounds, 2018;30: E57-E59.
- Tanasescu S., Joly P., Le Corvaisier-Pieto C., Dujardin F., Latouche J.B., Lauret P.. Acute necrotizing cutaneous streptococcal infection following bites or scratch by dog or cat. Annales de Dermatologie et de Vénéréologie, 1996; 123: 804-806.
- Wilcock B.P., Peiffer R.L.. The pathology of lens-induced uveitis in dogs. Veterinary Pathology, 1987; 24: 1549–1553.
- Streilein J.W.. Ocular immune provilege : therapeutic opportunities from an experiment of nature. Nature Reviews Immunology, 2003; 3: 879-889.
- Perez V.L., Saeed A.M., Tan Y., Urbieta M., Cruz-Guilloty F.. The eye: A window to the soul of the immune system. Journal of Autoimmunity, 2013; 45: 7-14.
- Caspi R.. Autoimmunity in the immune privileged eye: pathogenic and regulatory T cells. Immunologic Research, 2008; 42: 41-50.
- Tetas Pont R., Matas Riera M., Newton R., Donaldon D.. Corneal and anterior segment foreign body trauma in dogs: a review of 218 cases. Veterinary Ophthalmology, 2016; 19: 386-397.
- Lew M., Lew S., Drazek M., Pomianowski A.. Penetrating eye injury in a dog: a case report. Veterinarni Medicina, 2015; 60: 213-221.
- Belknap E.B.. Corneal Emergencies. Topics in Companion Animal Medicine, 2015; 30: 74-80.
- Grahn B.H., Szentimrey D., Pharr J.W., Farrow C..S, Fowler D.. Ocular and orbital porcupine quills in the dog: a review and case series. Canadian Veterinary Journal, 1995; 36: 488-493.
- Bussanich M.N., Rootman J.. Intraocular foreign body in a dog. Canadian Veterinary Journal, 1981; 22: 207–210.
- Cullen C.L., Grahn B.H.. Diagnostic ophthalmology. Right corneal foreign body, secondary ulcerative keratitis, and anterior uveitis. Canadian Veterinary Journal, 2005; 46: 1054–1055.
- Sandmeyer L.S., Bowen G., Grahn B.H.. Diagnostic ophthalmology. Anterior uveitis, cataract, retinal detachment, and an intraocular foreign body. Canadian Veterinary Journal, 2007; 48: 975-976.
- Schmidt G.M., Dice P.F., Koch S.A.. Intraocular lead foreign bodies in four canine eyes. Journal of Small Animal Practice, 1975; 16: 33–39.
- Slatter D.H., Bryan G.M.. An unusual foreign body in the anterior chamber of a dog. Veterinary Medicine and Small Animal Clinician, 1972;67: 775–778.
- Lit E.S., Young L.H.. Anterior and posterior segment intraocular foreign bodies. International Ophthalmology Clinics, 2002; 42:107-120.
- Labelle A.L.,Psutka K., Collins S.P., Hamor R.E.. Use of hydropulsion for the treatment of superficial corneal foreign bodies: 15 cases (1999-2013). Journal of the American Veterinary Medical Association, 2014; 244:476-479.
- Bell C.M., Pot S.A., Dubielzig R.R.. Septic implantation syndrome in dogs and cats: a distinct pattern of endophthalmitis with lenticular abscess. Veterinary Ophthalmology, 2013; 16: 180-185.
- Whitley R.D., Hamor R.E.. Diseases and surgery of the canine cornea and sclera. In: Veterinary Ophthalmology, 6th edn (eds Gelatt K.N., Ben-Schlomo G., Gilger CG, Hendrix D.V.H., Kern T.J., Plummer C.E.) Wiley-Blackwell, Ames, 2021; 1082–1172.
- Befanis P.J., Peiffer R.L., Brown D.. Endothelial repair of the canine cornea. American Journal of Veterinary Research, 1981; 42: 590–595.
- Kafarnik C., Murphy C.J., Dubielzig R.R.. Canine duplication of Descemet’s membrane. Veterinary Pathology, 2009; 46: 464–473.
